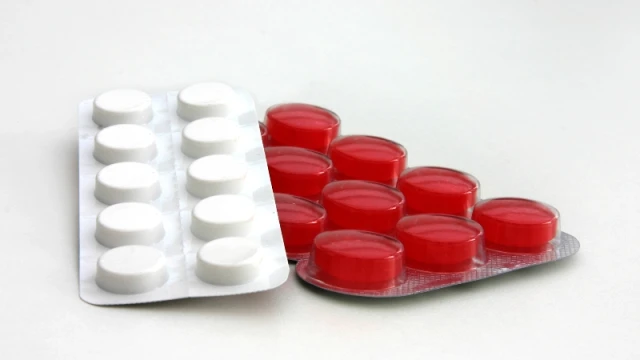
Министерството на здравеопазването е предприело действия във връзка с очертаващия се недостиг на лекарствения продукт CellCept.
Пациентски организации по-рано предупредиха за липсващо лекарство, което се приема всеки ден от голяма част от трансплантираните хора у нас. Медикаментът е имуносупресор, който помага на организма да не отхвърли трансплантирания орган.
„Медикаментът не е наличен в аптеките от около три седмици“, каза пред БНР Георги Пеев от Хасково, който е трансплантиран с два органа.
Съгласно направена справка в базата данни на Изпълнителна агенция по лекарствата (ИАЛ) и на официалната интернет страница на Европейката агенция по лекарствата, се установи, че има разрешени по централизирана процедура на ЕС четири лекарствени продукта с търговски имена CellCept, посочват от Министерството на здравеопазването.
Тези лекарствени продукти съответстват на международното непатентно наименование Mycophenolate, с притежател на разрешението за употреба (ПРУ) Roche Registration GmbH, Германия и представител на ПРУ за България „Рош България“ ЕООД
Понастоящем утвърдена цена от Националния съвет по цени и реимбурсиране на лекарствените продукти (НСЦРЛП) в страната, има един от тези лекарствени продукти, а именно CellCept 250 mg hard capsules x 100, който е включен в Приложение №1, №2 и №4 на Позитивния лекарствен списък (ПЛС) и се разпространява на нашия фармацевтичен пазар.
При проверка в регистъра на НСЦРЛП се установи, че единственият друг лекарствен продукт, включен в ПЛС и съответстващ на международно непатентно наименование Mycophenolic acid, е Myfortic Gastro-resistant tablet, 180 mg х 120 с притежател на разрешението за употреба Novartis Pharma GmbH, Германия.
Лекарственият продукт Myfortic е с издадено от Изпълнителната агенция по лекарствата разрешение за употреба по национална процедура и се реимбурсира от Националната здравноосигурителна каса с ниво 100%.
На 30.05.2023 г. в МЗ е постъпило уведомление, съгласно разпоредбите на чл. 54, ал. 4 от Закона за лекарствените продукти в хуманната медицина (ЗЛПХМ) за преустановяване на продажбите по непредвидени обстоятелства от 30.06.2023 г. на лекарствения продукт CellCept, поради производствени причини.
Във връзка с постъпилото уведомление, Министерството на здравеопазването незабавно е предприело следните действия:
-Своевременно е информирало Експертния съвет по медицинска специалност „Трансплантология“ за очертаващия се недостиг от лекарствения продукт CellCept.
-Същият ден са изготвени писма до ИАЛ и Българската асоциация за развитие на паралелната търговия с лекарства, с призив за извършване на всички възможни дейности, които биха довели до запазване на внесените в страната количества от лекарствения продукт и осигуряване на допълнителни такива с оглед непрекъсване на лечението на нуждаещите се пациенти в страната.
-Същевременно е изготвено писмо и към "Новартис България" ЕООД, притежател на разрешението за употреба на лекарствения продукт Myfortic, с искане за информация за внос на количества от лекарствения продукт през следващите няколко месеца, както и дали са в готовност за предприемане на действия по обезпечаване на нуждите на трансплантираните пациенти при евентуално завишено търсене.
В допълнение, МЗ проучва възможностите за включване след реализиране на съответната нормативна процедура на друг лекарствен продукт CellCept, а именно CellCept 500 mg film-coated tablets в списъка лекарствени продукти по чл. 266а от ЗЛПХМ. Разпоредбата по този член позволява, когато лечението на съответно заболяване е без алтернатива в страната, за конкретен пациент може да се прилага лекарствен продукт, който е разрешен за употреба в страна - членка на Европейския съюз, разрешен е за употреба по реда на този закон, но не се разпространява на българския пазар. Разпоредбата въвежда извънреден способ за осигуряване на лечението на българските граждани, когато по една или друга причина даден лекарствен продукт не е наличен на българския пазар – няма държавно регулирана цена и няма друга налична алтернатива за лечение.
Министерството на здравеопазването продължава да следи създалата се ситуация, като е в непрекъсната комуникация, както с регулаторните органи (НСЦРЛП и ИАЛ), така и с ПРУ на лекарствените продукти с INN -Mycophenolic acid, с цел обезпечаване терапията на българските пациенти.
Очакваме информация от представителя на ПРУ за България „Рош България“ ЕООД, дали ще бъде осъществен внос на CellCept 250 mg hard capsules x 100 от друга държава, с което ще се осигури лечението на пациентите за един месец.