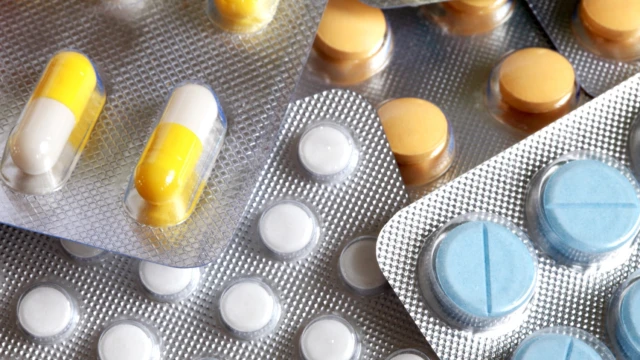
След предварителна оценка Европейската агенция по лекарствата (EMA) изчислява, че е възможно да има един допълнителен случай на рак на всеки 5 000 пациенти, приемащи засегнатите лекарства при най-високата доза валсартан (320 mg), всеки ден в продължение на 7 години. Изчислението се основава на средните нива на този примес, открити в активното вещество валсартан, произведено от Zhejiang Huahai Pharmaceuticals - (60 части на милион (ppm)).
Изчисленията са направени при допускане, че откритото количество примес в активното вещество е същото и в крайния лекарствен продукт. Посоченият риск е теоретичен, изчислен след проучвания при животни, статистика за опасността от рак в Евросъюза, и предвид факта, че примесът може да попадне в организма и от други източници – като храна и вода.
„Към текущия момент данните, които са дадени на база на математическата прогноза на ЕМА показват, че реално риска за здравето на пациентите в този момент няма”, коментира пред bTV магистър-фармацевтът Антон Вълев.
От фирмите, които са използвали активното вещество от китайския завод (Zhejiang Huahai), извършат анализ на мострите от крайните лекарствени продукти, които съхраняват, за да установят действителното количество на примеса (NDMА). Допълнителни проверки са извършени от официални контролни лаборатории на ЕС. Когато се получат данните от всичките тези анализи, EMA ще може да предостави повече информация относно риска от примеса за пациентите.
Няма непосредствен риск за пациентите, посочва ЕМА. Тези пациенти, които приемат засегнатите лекарства и още не са преминали на алтернативно лечение, не трябва да спират приема на своето лекарство, без да се консултират със своя лекар и фармацевт.
Лекарствата, съдържащивалсартан, се използват при пациенти със сериозни или потенциално сериозни сърдечносъдови заболявания (високо кръвно налягане, скорошен сърдечен инфаркт и сърдечна недостатъчност). По тази причина не се препоръчва пациентите да прекъсват лечението, в случай че то е било предписано.
Всички лекарства, съдържащи активното вещество валсартан, произведено от Zhejiang Huahai Pharmaceuticals, са блокирани и изтеглени от аптеките в ЕС, но има налични други лекарства, съдържащи валсартан, които не са засегнати от примеса. Пациентите, които искат да получат повече информация за своето лечение, трябва да се свържат със своя лекар или фармацевт.
NDMA не е очакван примес и се счита, че обяснение за неговата поява са промени в производствения процес, които Zhejiang Huahai Pharmaceuticals въвежда през 2012 г. Други активни вещества, произвеждани от фирмата, не са засегнати.
NDMA е класифициран като възможен канцероген при хората, въз основа данни от проучвания при животни. Веществото се открива в някои храни и водоизточници, но не се очаква да оказва вредно въздействие при поглъщане в много малки количества.
Агенцията по лекарствата в България (ИАЛ ) вече отблокира част от лекарствата на нашия пазар, тъй като фирмите са представили доказателства, че активното вещество в продуктите им е купено от друг завод, не този в Кита. Информация за отблокираните продукти може да намерите на сайта на ИАЛ www.bda.bg/bg/